Розробка уроку
Тема: створення і опрацювання моделей на прикладах задач з хімії.
Мета
навчальна — познайомити учнів зі створенням та опрацюванням моделей на прикладі задач з хімії;
розвивальна — розвиток пізнавальних інтересів, навиків роботи з Free Pascal i Libre Office, самоконтролю, уміння конспектувати.
виховна — стимулювати інтерес до предмету, пізнавальну активність, акуратність, терпимість та інформаційну культуру учнів.
Після вивчення теми учень
-
має уявлення про форми подання моделей;
-
розрізняє форми подання моделей;
-
пояснює:
-
розв'язання задач за допомогою Free Pascal i LibreOffice Calc;
-
роль планування та створення моделей, зокрема при навчанні.
Обладнання й матеріали: ПК з встановленими Pascal та LibreOffice, (дана) інструкція.
Структура уроку
-
Організаційний момент.
-
Актуалізація опорних знань.
-
Вивчення нового матеріалу.
-
Інструктаж з ТБ.
-
Закріплення вивченого матеріалу.
-
Підбиття підсумків уроку.
-
Домашнє завдання.
Хід уроку
1. Організаційний момент
Вітання з класом. Перевірка присутності й готовності учнів до уроку. Перевірка виконання домашнього завдання.
2. Актуалізація опорних знань-
За призначенням розрізняють моделі навчальні, дослідні, науково-технічні, імітаційні та інші. Які сфери застосування кожної з них?
-
За фактором часу розрізняють моделі статичні й динамічні. У чому різниця між ними?
-
За способом реалізації моделі поділяють на два види — матеріальні та інформаційні. У чому різниця між ними?
-
Що таке комп’ютерна модель?
-
Основні етапи комп’ютерного моделювання такі:
-
Постановка задачі та її аналіз.
-
Побудова інформаційної моделі.
-
Розробка методу й алгоритму дослідження моделі.
-
Розробка комп’ютерної моделі.
-
Проведення комп’ютерного експерименту.
У чому полягає їхня суть? -
За способом подання інформації інформаційні моделі поділяють на: словесні, графічні, структурні, алгоритмічні, розрахункові, спеціальні. Подайте приклади.
3. Вивчення нового матеріалу
Як ми вже дізналися, побудова будь-якої моделі — це достатньо складне завдання. Хоча вміння правильно змоделювати задачу корисне не лише під час вивчення інформатики, але навіть у повсякденному житті. Протягом цього уроку ми розглянемо приклади побудови і опрацювання моделей для конкретних хімічних задач. Фундаментом для нашої роботи будуть задачі, з якими ви вже зустрічались. Таким чином, ми зможемо як фахівці оцінити доцільність використання моделювання для вирішення завдань іншого предмету.
Будемо діяти за таким планом:
Ознайомитися з умовою задачі або чітко сформулювати її.
Проаналізувати умову задачі, тобто знайти відповіді на такі питання:
-
Що дано?
-
Що потрібно визначити?
-
При яких припущеннях?
-
У якому вигляді потрібно (доречно, найкраще) подати результати?
-
За яких умов можна отримати результати?
-
Які результати вважати правильними?
Передбачити розв'язання задачі з допомогою комп'ютера. Розв'язання задачу необхідно підготувати до втілення його програмою: підібрати формули, встановити порядок виконання дій тощо. Для алгоритмічно складних задач потрібно сформулювати розв'язання у вигляді, зручному для перекладу алгоритмічною мовою.
Визначити метод розв'язання задачі, від чого залежить, яку програму доцільно буде використати.
Розробити алгоритм на основі обраного методу
Втілити алгоритм за допомогою програмного забезпечення.
Протестувати й налагодити програму (електронний документ).
Провести остаточні розрахунки, проаналізувати отримані результати.
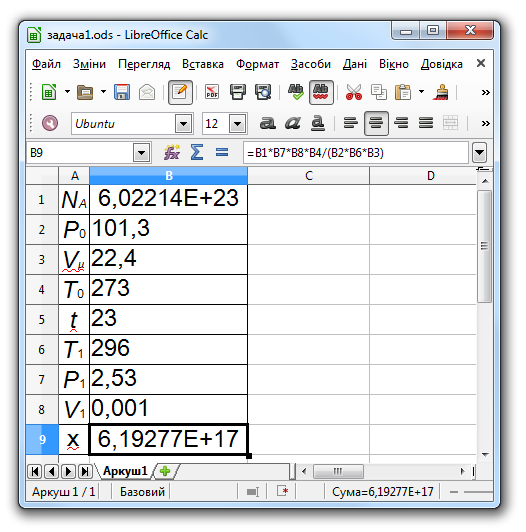
Задача 1. Скільки молекул міститься в 1 мл газу при температурі 23°C і тиску 2,53 кПа.
-
Умову задачі не вимагає переформулювання чи уточнення.
З умови задачі маємо:
дано:
t = 23°C — температура;
P1 = 2,53 кПа — тиск газу;
V1 = 0,001 л — об'єм газу;
потрібно знайти:
х — кількість молекул.
До формулювання умови завдання мають відношення такі факти.
Відношення добутку тиску і об'єму до абсолютної температури газу — стале:
P V / T = const.
NA = 6.02214129 · 1023 моль−1 — число Авогадро — стала кількість молекул в одному молі. Моль — це кількість речовини, виражена у грамах, що чисельно дорівнює її молекулярній масі.
Для розв'язання поставленого завдання використаємо аналітичний метод. У таких випадках доцільно використовувати табличні процесори або середовища прогамування — програми, що «вміють лише рахувати». Або ті, що «вміють робити аналітичні перетворення». Наприклад, систему алгебричних обчислень Reduce.
Сценарій розв'язання задачі: cпочатку визначити об'єм газу за нормальних умов, після чого визначаємо кількість молекул газу у 1 мл.
Розвязання задачі. Запровадимо такі позначення:
P0 = 101,3 кПа — тиск газу за нормальних умов;
V0 — об'єм газу за нормальних умов;
Vμ = 22,4 л/моль — об'єм одного моля газу за нормальних умов;
T0 — 273°К — абсолютна температура при нормальних умовах;
T1 = T0 + t — абсолютна температура газу.
З рівності: P0 V0 / T0 = P1 V1 / T1
маємо: V0 = P1 V1 T0 / (P0 T1).
З пропорції: x : NA = V0 : Vμ
маємо:
x = NA V0 / Vμ =
NA P1 V1 T0 / (P0 T1 Vμ ).
Комп'ютерна модель у середовищі LibreOffice Calc
Комп'ютерна модель в інтегрованому середовищі програмування мовою Pascal
Const
Na=6.02214129e23;
P0=101.3;
VM=22.4;
T0=273;
t=23;
P1=2.53;
V1=0.001;
BEGIN
writeln('Шукана кількість молекул: ',
NA*P1*V1*T0/(P0*(T0+t)*VM));
END.
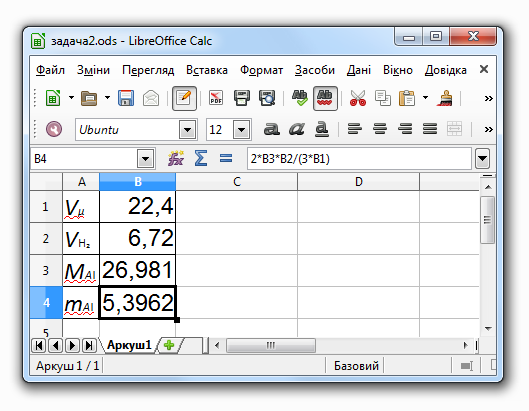
Задача 2. Визначити масу алюмінію Al, що може витиснути 6,72 л (за нормальних умов) водню Н₂ з сульфатної кислоти H₂SO₄.
З умови задачі маємо:
дано: VН₂ = 6,72 л — об'єм виділеного водню;
потрібно знайти: mAl — маса алюмінію.
Запровадимо такі позначення:
Vμ = 22,4 л/моль — об'єм одного моля газу за нормальних умов;
MAl = 26,981 г/моль — молярна маса алюмінію .
Молярну масу взято з таблиці Менделеєва.
Рівняння реакції має такий вигляд:
2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂.
(Згідно із законом кратних відношень) кількості речовин Al і H₂ (у молях) відносяться як 2:3, звідки
mAl / MAl = (2/3) · VH₂ / Vμ,
тому
mAl = 2MAl · VH₂ / 3Vμ.
Для вхідних даних маємо:
mAl = 2 · 26,981 · 6,72 / (3 · 22,4) = 5,3962 (г).
Комп'ютерна модель у середовищі LibreOffice Calc
Комп'ютерна модель в інтегрованому середовищі програмування мовою Pascal
Const
VM=22.4;
VH2=6.72;
MAl=26.981;
BEGIN
writeln('Шукана маса алюмінію: ',
2*MAl*VH2/(3*VM),' грам.')
END.
4. Інструктаж з ТБ
5. Закріплення вивченого матеріалу
Результат побудови комп'ютерної моделі у довільному середовищі записувати з назвою Ваше прізвище_Номер завдання у вказану вчителем теку.
Задача 3. Розчинність амоній сульфату (NH₄)₂SO₄ в інтервалі температур 20–90°С виражають такою залежністю:
S = 0,1 · t + 40,8. Тут
S — частка розчиненої речовини (масовий %) у насиченому водному розчині;
t — температура (°С).
Скільки грамів насиченого водного розчину амоній сульфату при температурі 26°С потрібно взяти для приготування 200 г розчину солі з масовою часткою 4%?
Задача 4. Розрахувати масу натрій гідроксиду NaOH, необхідного для повної нейтралізації 126 г розчину з масовою часткою 10% нітратної кислоти HNO₃.
Задача 5. Обчислити об’єм азоту N₂ і водню Н₂, необхідних для синтезу амоніаку NH₃ об’ємом 60 м3.
6. Підбиття підсумків уроку
Виставлення оцінок.
7. Домашнє завдання
Повторити вивчений матеріал.
Текст упорядкувала Тонковид Манрина Аркадіївна вчитель інформатики спеціалізованої школи № 135 Шевченківського району, під час виконання випускної роботи на курсах підвищення кваліфікації з 06.10.2014 до 25.10.2014.

