Тема: створення, опрацювання моделей і дослідження інформаційних моделей (задачі з хімії)
Мета
навчальна: формування навичок створення, опрацювання моделей і дослідження інформаційних моделей на прикладі розв'язування задач з хімії, використуваючи навики роботи з програмами Pascal та програм Libre Office
розвивальна: розвиток пізнавальних інтересів, самоконтролю.
виховна: стимулювати інтерес до предмету, пізнавальну активність, акуратність, інформаційну культуру учнів.
Після виконання практичної роботи учень
Розв’язання прикладної задачі вимагає створення моделі, яка описує реальні об’єкти та відносини між ними у межах цієї задачі. Для досліджень об’єкта (явища, процесу) не обов’язково створювати матеріальну модель, часто досить надати необхідну інформацію про об’єкт у потрібній формі, тобто створити інформаційну модель.
Інформаційна модель — це абстрактний об’єкт, який замінює об’єкт оригінальний із метою його дослідження, зберігаючи при цьому типові риси та властивості оригіналу, важливі для дослідження.
При створенні моделі треба визначити основні характеристики об’єкта та допустимі відхилення в описі цих характеристик, вхідні характеристики, взаємовідносини характеристик. Від поставленої задачі залежить повнота розробки та аналізу моделі. Інформаційна модель може бути описана різними засобами: природною мовою, мовою математики, хімії, біології, мовою графічних структур тощо.
За призначенням розрізняють моделі навчальні, дослідні, науково-технічні, імітаційні та інші. Які сфери застосування кожної з них?
За фактором часу розрізняють моделі статичні й динамічні. У чому різниця між ними?
За способом реалізації моделі поділяють на два види — матеріальні та інформаційні. У чому різниця між ними?
Основні етапи комп’ютерного моделювання такі:
У чому полягає їхня суть?
За способом подання інформації інформаційні моделі поділяють на: словесні, графічні, структурні, алгоритмічні, розрахункові, спеціальні. Подайте приклади.
Ознайомитися з умовою задачі або чітко сформулювати її.
Проаналізувати умову задачі, тобто знайти відповіді на такі питання:
Передбачити розв'язання задачі з допомогою комп'ютера. Розв'язання задачу необхідно підготувати до втілення його програмою: підібрати формули, встановити порядок виконання дій тощо. Для алгоритмічно складних задач потрібно сформулювати розв'язання у вигляді, зручному для перекладу алгоритмічною мовою.
Визначити метод розв'язання задачі, від чого залежить, яку програму доцільно буде використати. Найчастіше при розв'язуванні задач з хімії розв'язують рівняння (зазвичай пропорції) відносно деяких величин. У такому випадку однаково зручними є і традиційні мови програмування, і електронні таблиці.
Розробити алгоритм на основі обраного методу. У поданих далі завданнях це є обчислення згідно з отриманими формулами.
Втілити алгоритм за допомогою програмного забезпечення.
Протестувати й налагодити програму (електронний документ).
Провести остаточні розрахунки, проаналізувати отримані результати.
3. Інструктаж з ТБ
4. Вироблення практичних навичок
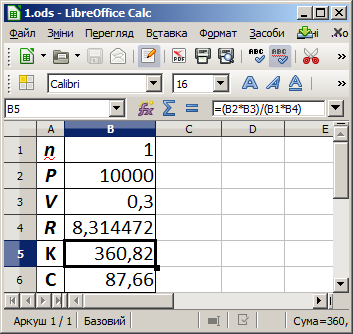
Задача 1. Знайти температуру, при якій у 300 мл газу і тиску 10 кПа міститься 1 моль речовини.
З умови задачі маємо:
дано:
n = 1 моль — кількість речовини;
P = 10 кПа — тиск газу;
V = 300 мл = 0,3 л — об'єм газу;
потрібно знайти:
Т — температуру.
Для розв'язування задачі створюємо інформаційну модель на основі рівняння (закону) Клапейрона-Менделєєва:
де R = 8,314472 Дж/(моль · K) = 0,082 л·атм/(моль · K) — універсальна газова стала, n — кількість речовини (у молях), тобто відношення маси до молярної маси.
Розв'язавши рівняння відносно Т, отримаємо:
Для вхідних даних маємо:
що складає 87,66°C.
Комп'ютерна модель у середовищі LibreOffice Calc

Комп'ютерна модель у середовищі програмування мовою Pascal
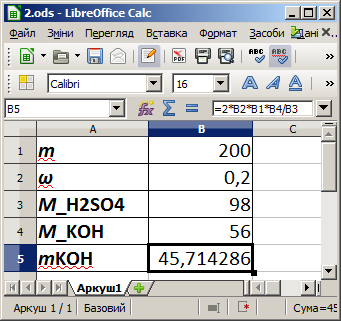
const n=1; P=10000; V=0.3; R=8.314472; T0=273.16; var T: real; BEGIN T:=(P*V)/(n*R); writeln(T:6:2,'K',(T-273.16):9:2,'C'); END.Задача 2 (реакція нейтралізації). Знайти масу калій гідроксиду (KOH), необхідну для нейтралізації 200 г 20% розчину сульфатної кислоти (H₂SO₄).
Рівняння реакції має такий вигляд:
Для вхідних даних маємо:
— результат подано періодичним десятковим дробом.
Комп'ютерна модель у середовищі LibreOffice Calc
Комп'ютерна модель в інтегрованому середовищі програмування мовою Pascal
var mKOH: real;
const m=200;
w=0.2;
M_KOH =56;
M_H2SO4=98;
BEGIN
mKOH:=2*w*m*M_KOH/M_H2SO4;
writeln('Maca MOH',mKOH:18:13);
END.
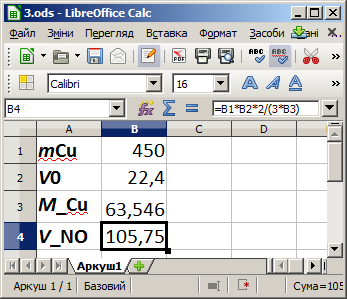
Задача 3 (окисно-відновні реакції). Визначити, скільки літрів газу Нiтроген (II) оксиду (NO) виділиться при розчиненні 450 г міді (Cu) у нітратній кислоті HNO₃ за стандартних умов.
З умови задачі маємо:
дано:
mCu = 450 г — маса міді;
потрібно знайти:
VNO — об'єм виділеного газу.
Запровадимо такі позначення:
V0 — об'єм, який займає 1 моль газу за стандартних умов, — 22,4 л/моль;
MCu — молярна маса міді — 63,546 г/моль.
Рівняння реакції має такий вигляд:
Для вхідних даних маємо:
Комп'ютерна модель у середовищі LibreOffice Calc
Комп'ютерна модель у середовищі програмування мовою Pascal
const V0=22.4;
mCu=450;
M_Cu=63.546;
var V_NO: real;
BEGIN
V_NO:=V0*mCu*2/(3*M_Cu);
writeln('V_NO', V_NO:8:2);
END.
5. Формування навчального досвіду
Самостійно побудувати й описати моделі розв'язання наступних задач.
Задача 4. На основі рівняння реакції
обчислити відсоткову концентрацію кислоти (масову частку), якщо відомо, що при реакції виділилось 100 л Нiтроген (II) оксиду (NO), а маса розчину кислоти складає 1 кг.
Задача 5. Скільки водню (H₂) виділиться при розчинені 100 г заліза (Fe) у хлоридній кислоті (HCl):
6. Підбиття підсумків уроку
Виставлення оцінок.
7. Домашнє завдання
Повторити вивчений матеріал.
Текст упорядкувала Лозовська Людмила Павлівна, вчитель інформатики Міжшкільного навчально-виробничого комбінату Святошинського району міста Києва під час виконання випускної роботи на курсах підвищення кваліфікації з 24.11.2014 по 12.12.2014.